Definición de Química
Se denomina química a la ciencia que estudia tanto la composición, estructura y propiedades de la materia como los cambios que ésta experimenta durante las reacciones químicas y su relación con la energía.
Históricamente la química moderna es la evolución. de la alquimia tras la Revolución química.
Historia de la Química
Clasificación de la Química
1.-Química
General: Es la ciencia que estudia tanto la composición, estructura y
propiedades de la materia como los cambios que ésta experimenta durante las
reacciones químicas y su relación con la energía.
2.-.-Química Especial: Es aquella que
estudia la Química tanto orgánica como inorgánica y la química analítica , a su
vez se divide en.
- Química Inorgánica: se la llama también mineral porque estudia todos los elementos químicos que componen los cuerpos sin vida. Ej. Hierro, oro, plata , etc.
Química Organica: Se
le da también el nombre de química del carbono estudia el carbono y sus
combinaciones con el hidrogeno para formar los hidrocarburos. asi por ejemplo:
el estudio del gas doméstico que esta formado por lo primeros 4 gases: metano,
etano, propano, y butano.
Química Analítica: Identifica los
elementos que forman un compuesto mediante el análisis cualitativo y
cuantitativo.
*Análisis Cualitativo: este análisis identifica que clase
de
elementos forman un compuesto.
* Análisis Cuantitativo: este analisis identifica que clase de elemntos
forman un compuesto asi por ejemplo si tenemos la molécula de agua
decimos que está formada por dos átomos de hidrógeno y uno de
oxígeno.
elementos forman un compuesto.
* Análisis Cuantitativo: este analisis identifica que clase de elemntos
forman un compuesto asi por ejemplo si tenemos la molécula de agua
decimos que está formada por dos átomos de hidrógeno y uno de
oxígeno.
Bioquímica:
estudia las diferentes reacciones químicas que se realizan en el interior de
los seres vivos.
3.- Química Aplicada: dentro de esta
clasificación anotamos las siguientes:
Geología: por medio de los geologos nos
ayudan a identificar la composicion de los suelos asi por ejemplo. con las
muestras de suelo podemos darnos cuenta que abono necesita para que sea
fertil.
Mineralogía: Estudia todos los minerales
que se pueden extraer en la corteza terrestre por ejemplo . el oro, plata ,
estaño , etc.
Petroquímica: estudia el petróleo y sus
derivados: cosméticos, acetona, diesel, etc..
FORMULACIÓN DE QUÍMICA INORGÁNICA
1. VALENCIA.
Es la capacidad
que tiene un átomo de un elemento para combinarse con
los átomos de otros elementos y formar compuestos.
La valencia es un número, positivo
o negativo, que nos indica el número de electrones que gana,
pierde o comparte
un átomo con otro átomo o átomos.
2. NOMENCLATURAS.
Para nombrar los compuestos químicos inorgánicos se siguen las normas de la IUPAC
(unión internacional de química pura y aplicada). Se aceptan tres tipos de nomenclaturas
para los compuestos inorgánicos,
la sistemática, la nomenclatura de stock y la nomenclatura tradicional.

3. ÓXIDOS.
Son compuestos binarios formados por la combinación de un elemento y oxígeno. Hay dos clases de óxidos que son
los óxidos básicos y los óxidos
ácidos (anhídridos).

3.1. ÓXIDOS BÁSICOS.
Son compuestos
binarios formados por la combinación de un metal y el oxígeno. Su fórmula
general
es:
M2OX
Donde M es un metal y X la
valencia del metal (el 2 corresponde a la valencia del oxígeno).

3.2.
ÓXIDOS ÁCIDOS O ANHÍDRIDOS.
Son compuestos binarios formados por un no metal y oxígeno. Su fórmula general es:
N2OX
Donde N es un no metal
y la X la valencia del no metal (el 2
corresponde a la valencia del oxígeno).

5. HIDRUROS.
Son compuestos binarios formados por un metal e Hidrógeno. Su fórmula general es:
MHX
Donde M es un metal
y la X la valencia
del metal.

6. ÁCIDOS HIDRÁCIDOS.
Son compuestos binarios formados por un no metal e hidrógeno. Los no metales que forman estos ácidos son los siguientes:
- Flúor, Cloro, Bromo, Yodo( todos ellos funcionan con valencia 1)
- Azufre, Selenio, Teluro( funcionan con valencia 2)
• Fluor, cloro, bromo, yodo (todos ellos funcionan con la valencia 1)l es:
Su fórmula general es:
HxN
Donde N es el
no metal y la X la valencia del no metal. (El hidrógeno funciona con valencia
1).

7. HIDRÓXIDOS.
Son compuestos formados por un metal y el grupo hidroxilo
(OH). Su fórmula general es:
M(OH)X
Donde M es un metal
y la X la valencia
del metal

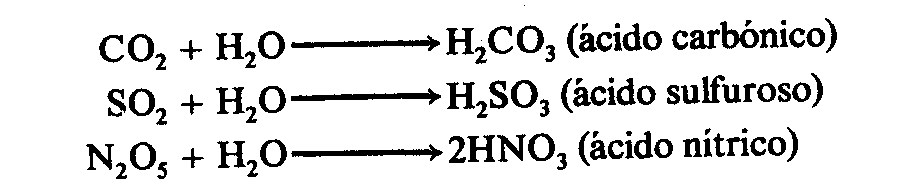
8. ÁCIDOS OXÁCIDOS.
Son compuestos
ternarios formados por un no metal,
oxígeno e hidrógeno.
Se obtienen a partir del óxido ácido o anhídrido
correspondiente sumándole una molécula
de agua (H2O).
Su fórmula general es:
H2O + N2Ox
= HaNbOc
Donde H es el hidrógeno, N el no metal y O el oxígeno.
9. SALES DE ÁCIDOS
HIDRÁCIDOS.
Se obtienen sustituyendo los hidrógenos del ácido hidrácido correspondiente por un metal.
Se nombran con el nombre del no metal terminado
en
–uro seguido del nombre
del metal. Si el metal
tiene
más de una valencia se indica al final, en números
romanos y entre paréntesis.
El número de hidrógenos
que se le quitan al ácido se le
pone como subíndice al metal.
Ácido
hidrácido
|
Fórmula
|
N. tradicional
|
HF
|
CaF2
|
Fluoruro cálcico
|
HCl
|
FeCl2
|
Cloruro
férrico
|
HBr
|
||
HI
|
||
H2S
|
Pt2S4 = PtS2
|
|
H2Se
|
Al2Se3
|
|
H2Te
|
Telururo aúrico
|
9. SALES DE ÁCIDOS OXÁCIDOS.
Son compuestos
ternarios formados por un metal, un no metal y el oxígeno.
Se obtienen a partir de los ácidos oxácidos sustituyendo
los hidrógenos de éstos
por un metal.